近日,我校生命科学学院林圣彩教授团队在《Nature Communications》杂志上在线发表了题为“Tip60 -mediated lipin 1 acetylation and ER translocation determine triacylglycerol synthesis rate”的研究论文。该工作揭示了乙酰转移酶TIP60通过乙酰化脂肪合成途径的代谢酶lipin 1并促进其向内质网转运,从而提高脂肪合成速率,揭示了TIP60作为一个“节俭基因”的功能和作用机制。这是继该团队在4月3日在《Cell Metabolism》杂志以封面故事阐明AIDA这一“浪费基因”通过抑制脂肪合成而抵御肥胖的机制后,在脂代谢调控领域的又一重要发现。
人类遗传学家James V. Neel在1962年首次提出了“节俭基因”这一概念,认为现今人类导致包括肥胖症、糖尿病和高血压等代谢障碍的基因是因为生理系统为了适应远古环境食物富足和食物缺乏的周期性改变而筛选出的,可以让远古人类在食物富足的短暂时期中快速增肥,以应对随时将到来的食物缺乏时期。这类基因在当时环境下有很大的优越性,但对于当今食物富足的社会则截然相反。这篇论文中林圣彩教授团队指出,TIP60这个经典的转录调控因子同时也是一个“节俭基因”。
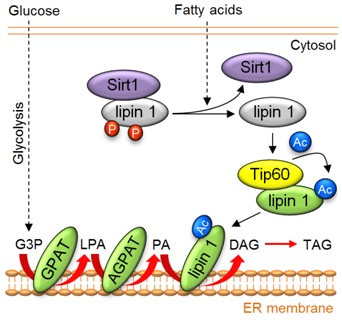
林圣彩教授团队对乙酰转移酶TIP60的研究始于GSK3-TIP60-ULK信号轴在生长因子缺乏的情况下能诱导细胞自噬发生的发现(Science, 2012)。该发现入选了“2012年度中国科学十大进展”。在《Science》的工作中,该团队发现TIP60的86位丝氨酸位点的磷酸化修饰是细胞代谢调控的一个关键事件。因此,他们在这项工作之后立即构建了该位点的基因突变的基因敲入小鼠。该团队发现,表达TIP60的活性下降的该突变体的敲入小鼠能显著抵御肥胖,而且带有该突变的雌鼠也因为乳汁中脂肪含量下降而无法哺育幼崽。肥胖的特征之一是脂肪组织中过量的脂肪酸通过脂肪合成途径被转变成甘油三酯(脂肪)。而lipin 1就是脂肪组织中脂肪合成途径的代谢酶之一。通过深入研究,该团队发现,脂肪酸能促使乙酰转移酶TIP60乙酰化lipin 1,并增强其lipin 1向内质网转运。而内质网则是脂肪合成途径的其他代谢酶的聚集场所,因此,该过程导致脂肪合成速率增强。接着,该团队进一步揭示了去乙酰化酶Sirt1起到拮抗TIP60、抑制lipin 1乙酰化修饰并抑制脂肪合成的作用。此外,该团队通过对酿酒酵母的研究,也证实了上述TIP60对脂肪合成的调控作用在进化上是保守的。
该研究阐明了脂肪合成途径中首个受蛋白质乙酰化修饰调控的途径,揭示了TIP60作为经典转录调控因子之外的又一重要生物学功能,为开发防治肥胖症及其相关代谢紊乱疾病提供了新的药物作用靶点。博士后李阳、博士生宋林涛和硕士生孙玉是该论文的共同第一作者。该研究受到了国家自然科学基金和中国国家重点研发计划项目的资助。
文章链接:https://www.nature.com/articles/s41467-018-04363-w
