近日,我校药学院周强教授课题组在国际顶级学术杂志《自然》上在线发表了题为
“Phase
separation mechanism for C-terminal hyperphosphorylation of RNA polymerase
II”的研究论文。该工作阐释了蛋白激酶中含有的组氨酸富集结构域(Histidine-Rich
Domain,
HRD)可以通过相位分离(Phase
separation)对细胞基因转录进行调控的分子机制。该研究成果为进一步阐释该机制提供了全新的视角和概念;为以依托此机制进行的药物设计、筛选和开发提供了新思路、新靶点和新模型。因此,
该成果在理论研究及应用方面均具有重大意义。
基因转录是细胞基因表达和行使正常功能必不可少的重要环节。它的异常调控往往会引起不同疾病的发生;因此,转录调控机制及相关药物开发一直是生物医药领域研究的热点之一。人类细胞的编码基因是由RNA聚合酶II(Pol
II)
负责转录,它是由一系列精密调控且高效的生化反应所组成。其中的一个重要反应是由转录激酶P-TEFb对Pol II
的CTD结构域进行磷酸化高度修饰(Hyperphosphorylation),从而实现Pol
II的高效转录延伸。CTD
上有许多磷酸化修饰位点,但使得P-TEFb对CTD进行高度修饰所需的识别及作用机制则尚未得到阐释。由于高效特异性的蛋白互作结构域往往具有刚性不易变的三维空间结构,我们可以将由精准蛋白互作介导的基因转录调控称为“刚性机制”。但近期的研究发现负责调控转录的蛋白常含有大量不可定义三维空间结构的片段,它们通常被称为低复杂性区域(Low
Complexity Domain, LCD)或内在无序区域(Intrinsically
Disordered Region, IDR)。研究表明,含有LCD/IDR的蛋白可以通过相位分离(类似日常生活中见到的油水分离)的方式聚合形成液滴状的特殊结构。这些结构可在一定的条件下从水溶液中分离出来,形成局部富集结构并极大促进存在于其中的各类生化反应的进行,同时也能与周围环境交换物质。由于LCD/IDR并不具有稳定的三维空间结构,其可塑性强,因此我们可以将由LCD/IDR介导的生物活性调控称为“柔性机制”。
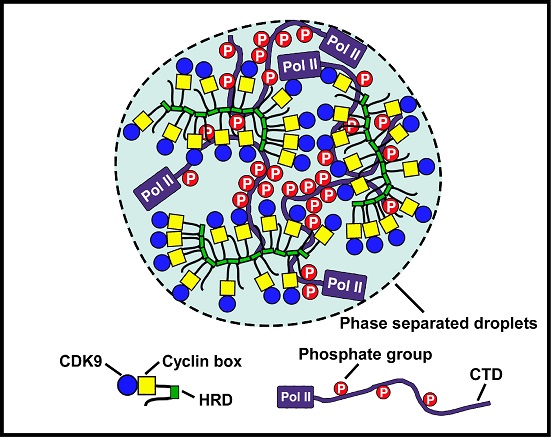
周强教授课题组的这项研究正是揭示了“柔性机制”在转录过程中的重要作用。他们发现
P-TEFb亚基CycT1及另一基因特异性转录调控因子DYRK1A上均含有进化上保守的组氨酸富集结构域(HRD),并与其上下游序列一起形成一个大的内在无序区域(IDR)。课题组发现该区域在体外可以通过HRD分子间的相互作用以相位分离的方式聚合形成液滴状结构。在细胞核内,CycT1和DYRK1A则依赖HRD形成斑点结构(nuclear
speckle)并可发生动态融合。在进一步的研究中,他们发现
HRD又能以和CTD直接作用的方式招募并富集Pol
II到HRD形成的液滴中。当用药物破坏HRD形成的相变结构后,课题组发现
PolII
CTD高度磷酸化修饰也被抑制了。此前研究表明CycT1 Cyclin
Box结构域可以用“刚性机制”的方式特异性结合P-TEFb激酶亚基CDK9。将此与本次研究相结合,课题组团队证实了CycT1通过“刚柔并济”的方式富集CDK9和Pol
II到相位分离形成的液滴状结构中,从而最大化地促进Pol II
CTD磷酸化及转录延伸活性。
由于过去靶向药物设计多以“刚性机制”中的三维结构域为靶点,周强教授课题组对“柔性机制”的深入研究无疑会为药物设计提供新思路、新靶点。因此,
该成果在理论研究及应用方面均具有重大意义。
该论文的第一作者是陆华松博士,其研究部分依托于四海资讯红足药学院、福建省药物新靶点研究重点实验室和细胞应激生物学国家重点实验室等平台完成。
论文链接:https://www.nature.com/articles/s41586-018-0174-3
