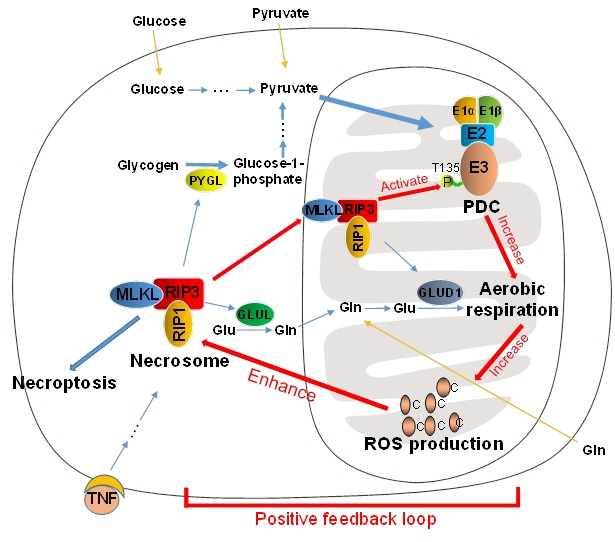
近日,国际知名学术刊物《Nature Cell Biology》在线发表了我校韩家淮教授课题组的最新研究成果“RIP3 Targets Pyruvate Dehydrogenase Complex to Increase Aerobic Respiration in TNF-induced Necroptosis”,揭示了在 TNF 刺激下RIP3 通过磷酸化激活丙酮酸脱氢酶复合体 (PDC),促进细胞耗氧及 ROS 产生,增强坏死小体形成的分子机制。
程序性细胞坏死是细胞内一种受严格调控的细胞死亡方式,它参与到机体的多种病理过程中。现有研究表明细胞糖原代谢及谷氨酰胺代谢参与细胞坏死过程,且 RIP3 介导的 ROS 产生在坏死过程中具有重要作用,然而 ROS 的具体产生机制还不完全清楚。
丙酮酸脱氢酶复合体 (PDC)是细胞糖代谢过程中的关键酶,由 PDC E1α,E1β, E2 及 E3 亚基组成。PDC 催化丙酮酸生成乙酰辅酶A而进入三羧酸循环,是连接糖酵解与线粒体呼吸的桥梁。现有研究表明 PDC 的活性由 E1 α 亚基的磷酸化水平调控,而 PDC 的活性异常与细胞衰老,及癌症、糖尿病、心脏病等多种疾病相关。
韩家淮教授课题组的研究发现,在 TNF 刺激下,RIP3 可直接与 PDC 相互作用并磷酸化其 E3 亚基的 T135 位点 ,该位点的磷酸化导致 PDC 的活性上升,从而促进细胞耗氧及 ROS 的产生。ROS 通过氧化 RIP1 上的关键半胱氨酸而增强其激酶活性,从而正反馈增强坏死小体的形成。
该研究工作发现了受 RIP3 调节的新底物,揭示了 PDC 活性的全新调控方式,并全面探讨和验证了细胞坏死过程中 RIP3 介导的代谢调控机制及作用。并且,由于 PDC 活性与多种生理过程及疾病相关,该研究成果可能在相关疾病研究过程中具有重要意义。
博士研究生杨镇滔为该论文的第一作者,硕士研究生王燕为第二作者。该项研究得到了973计划和国家自然科学基金委员会重点和重大研究计划项目的经费支持。论文提出的模式图如下:
全文链接:https://www.nature.com/articles/s41556-017-0022-y
